2020上半年,面对疫情影响,我国新药的审评审批工作在上半年仍在积极有序推进,统计信息显示,2020年上半年获批的新药数量已明超过2019年同期。与此同时,我国新《药品注册管理办法》及配套法规文件陆续发布,这些新制度的平稳有效落地必将对鼓励创新、加快国内外具有临床价值的新药研发和上市,进一步提升药品质量,保障药品安全和有效发挥重要的作用。
在“创新引领健康中国”这一理念的引领下, RDPAC及会员企业一直致力于创新药的研发与引进,坚持以患者为中心,让全球创新药研发带来的突破性成果早日惠及我国患者。据不完全统计,2020年上半年(1月1日至6月30日),RDPAC会员企业共有15款进口新药获得国家药品监督管理局(NMPA)批准上市(表1),占同期获批进口新药的88%。这15款进口新药治疗领域覆盖中国患者群体高负担病种的癌症、罕见病、自身免疫疾病、呼吸系统疾病等多个疾病领域,包括3款抗癌药、4款罕见病药等药物。此外,在2020年上半年,RDPAC会员企业的10个已在国内上市的创新药共获批了12个新适应症(表2)。
加速临床急需境外新药的相关政策是自2018年以来药监改革的重点之一,国家药品监督管理局药品审评中心当前已发布了两批《临床急需境外新药名单》,2020年上半年,有10款RDPAC会员企业的药物(包含新适应症)就是通过该政策途径成功实现获批上市。此外,药监部门一系列改革措施促进了全球同步研发递交,从而促进了创新药的引进,例如在上半年获批的乙磺酸尼达尼布软胶囊新适应症,是该RDPAC会员企业在中国的首次全球同步递交,此次获批仅比在欧盟获批晚了一个半月。未来,在鼓励创新的政策支持下,将有更多全球医药创新成果惠及我国尚未被满足临床治疗需求的患者。
表1:2020上半年RDPAC会员企业获批上市新药汇总
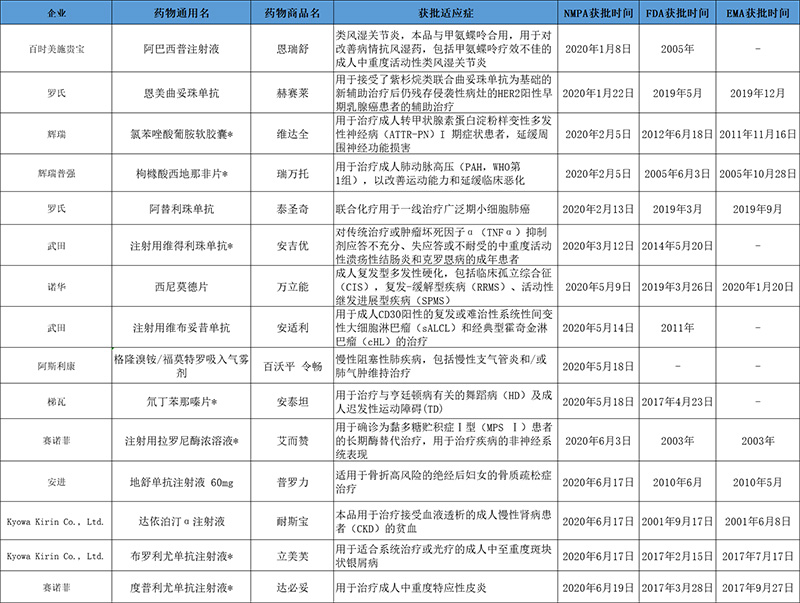
注:来源为RDPAC各会员企业资料及公开信息,数据截至2020年6月30日,*为《临床急需境外新药名单》中的上半年获批新药
表2:2020上半年RDPAC会员企业获批上市新适应症汇总
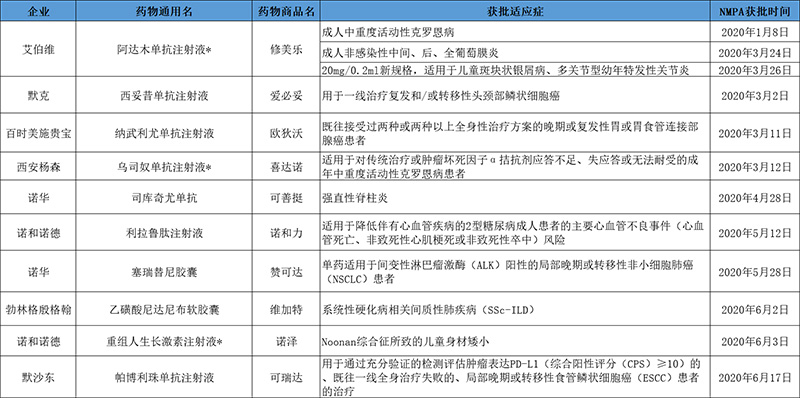
注:来源为RDPAC各会员企业资料及公开信息,数据截至2020年6月30日,*为《临床急需境外新药名单》中的上半年获批新适应症的新药
以下为2020年上半年RDPAC会员企业获得NMPA上市批准的新药及新适应症的具体内容。
一、获批新药的创新治疗突破点
1、阿巴西普注射液(百时美施贵宝):
全球类风湿关节炎领域第一个T细胞选择性共刺激免疫调节剂。相关多项研究表明,阿巴西普能改善类风湿关节炎患者症状,降低疾病活性,延缓关节结构性损伤的进展,提高患者生理功能;同时,它还被证实具有良好的安全性。一个美国医保数据库的数据表明,与目前常用的生物制剂TNF-α抑制剂相比,使用阿巴西普的患者住院感染风险降低了22.6%,并且没有严重警告级别的住院感染风险。针对多项国际多中心研究的综合分析表明,使用阿巴西普发生结核病的风险很低;同时,中国患者人群与全球患者人群在使用阿巴西普的疗效与安全性方面无种族差异,其原装进口的预充针剂型也更加方便患者使用。
2、恩美曲妥珠单抗(罗氏):
作为全球首个获批的单药治疗实体瘤的抗体药物偶联物(ADC,Antibody-Drug Conjugates),同时也是中国第一个HER2靶向ADC产品,该药不仅丰富了我国HER2阳性乳腺癌患者在新辅助治疗手术后仍有残存病灶强化辅助治疗的选择,也让这部分高危复发风险的患者离治愈更近一步。
3、氯苯唑酸葡胺软胶囊(辉瑞):
全球首个转甲状腺素蛋白稳定剂,填补了此前中国在转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)I期症状性成人患者治疗领域无有效药物的空白。ATTR-PN是一种遗传性罕见致死性神经退行性疾病,成年患者发病主要表现为对称性由肢体远端向近端进展的神经功能障碍,并可伴有严重的心脏、肾脏、消化道和眼部等其他脏器受损,约在起病后10年左右,逐渐进展至终末期。
4、枸橼酸西地那非片(辉瑞普强):
是国内首个被批准用于治疗肺动脉高压的5型磷酸二酯酶(PDE-5)抑制剂。目前肺动脉高压无法被治愈,但经过及早正确诊断和必要的药物治疗,可以改善和延缓病情恶化。
5、阿替利珠单抗(罗氏):
阿替利珠单抗联合化疗是全球第一个,且目前中国唯一一个获批用于一线治疗广泛期小细胞肺癌的肿瘤免疫疗法。阿替利珠单抗也是超过30年来第一个被证明给小细胞肺癌患者带来明显获益的创新药。
6、注射用维得利珠单抗(武田):
目前炎症性肠病领域唯一的肠道选择性生物制剂。其临床数据表明能够快速起效并实现长期持久的临床缓解和黏膜愈合,同时安全性好,是欧美国际指南推荐的一线生物制剂。
7、西尼莫德片(诺华):
目前全球首个、唯一用于治疗活动性继发进展型多发性硬化(SPMS)的口服疾病修正治疗(DMT)药物。
8、注射用维布妥昔单抗(武田):
由靶向CD30的单克隆抗体连接一种抑制微管的细胞毒药物(单甲基澳瑞他汀E,MMAE)组成,可在血液中稳定存在,精准杀灭表达CD30的肿瘤细胞。
9、格隆溴铵/福莫特罗吸入气雾剂(阿斯利康):
创新共悬浮技术,使药物深入畅达肺部大小气道,肺部沉积率高达48%。
10、氘丁苯那嗪片(梯瓦):
使用的氘代技术给予了活性成分良好的药代动力学曲线,从而允许减少给药频率,同时显示出对亨廷顿病舞蹈病和成人迟发性运动障碍患者的有效性和可接受的安全性和耐受性。目前在中国对迟发性运动障碍尚无明显有效的疗法。
11、注射用拉罗尼酶浓溶液(赛诺菲):
黏多糖贮积症Ⅰ型是一种主要在儿童期发病的罕见遗传病,严重损害儿童身心健康。注射用拉罗尼酶浓溶液是全球首个也是目前唯一批准治疗黏多糖贮积症Ⅰ型(MPS Ⅰ)的酶替代疗法,同时也是中国唯一治疗MPS Ⅰ的特异性治疗药物,可以用于所有年龄段和不同疾病严重程度的MPS Ⅰ患者,填补了国内特异性治疗药物的空白和临床未被满足的需求。
12、地舒单抗注射液60mg(安进):
中国首个,也是目前唯一一个用于骨质疏松症治疗的抗RANKL单抗类药物,可帮助绝经后妇女显著降低椎体、非椎体及髋部骨折的发生风险,为中国患者的骨健康管理与生活质量改善带来创新机遇。
13、达依泊汀α注射液(Kyowa Kirin Co., Ltd.):
这是首个长效EPO-α制剂(达依泊汀α注射液)在中国获批上市,为我国肾性贫血患者的治疗带来了新的选择。达依泊汀α是一种长效的促红素制剂,通过基因工程和糖蛋白工程技术,对传统促红细胞生成素(EPO)结构加以改造,提高了其受体亲和力、血浆半衰期和生物活性。达依泊汀α的半衰期是传统短效EPO制剂的三倍,用药间隔延长至每周一次或每两周一次。
14、布罗利尤单抗注射液(Kyowa Kirin Co., Ltd.):
布罗利尤单抗是国内首个获批的白介素17受体A的抑制剂,不仅能够抑制白介素17A,而且还能抑制白介素17C,17F和17E,它通过全面抑制IL17家族,并且作用于白介素17反应通路的下游,其独特的作用机制为中国银屑病患者的治疗带来新选择及更多的临床获益可能。
15、度普利尤单抗注射液(赛诺菲):
是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,填补了国内临床未被满足的需求,能快速、显著、持续地改善特应性皮炎患者的皮损程度和瘙痒症状。
二、获批新适应症的创新治疗突破点
1、阿达木单抗注射液(艾伯维):
(1)成人中重度活动性克罗恩病:克罗恩病首个获批的全程皮下注射全人源单抗。全人源TNFi 快速强效,长期疗效佳,皮下注射剂型让患者可自行在任何地方自我注射,为患者提供了灵活便捷的治疗方式,更有利于提高患者的治疗依从性。
(2)成人非感染性中间、后、全葡萄膜炎:中国首个获批治疗非感染性中、后、全葡萄膜炎的生物制剂。修美乐强效持久,显著降低活动性患者前房细胞评级、玻璃体混浊评级、改善最佳矫正视力,减少新生炎症病变;且显著减少激素用量。2019年,修美乐治疗非感染性中间、后、全葡萄膜炎的适应症被中国国家药品监督管理局药品审评中心(CDE)列入第二批临床急需境外新药名单。2014年,美国食品药品监督管理局(FDA)授予了修美乐治疗特定类型葡萄膜炎的孤儿药地位。
(3)儿童斑块状银屑病、多关节型幼年特发性关节炎:在这两个儿科适应症领域均是国内首个且目前在我国唯一获批的生物制剂疗法,填补相应治疗领域的空白。
2、西妥昔单抗注射液(默克):
与铂类和氟尿嘧啶化疗联合,用于一线治疗复发和/或转移性头颈部鳞状细胞癌,打破了中国复发和/或转移性头颈部鳞状细胞癌患者30年来铂类化疗效果不佳的困局,填补了头颈部鳞癌领域靶向治疗的空白。
3、纳武利尤单抗注射液(百时美施贵宝):
是中国首个且目前唯一获批用于晚期胃癌治疗的免疫肿瘤药物。晚期三线或三线以上胃癌患者一旦获益于欧狄沃,其中有61.3%患者的生存期可延长至两年以上;与对照组相比,欧狄沃可降低38%死亡风险,提高一年生存率超2倍。
4、乌司奴单抗注射液(西安杨森):
是国内获批的首个全人源“双靶向”白细胞介素12(IL-12)和白细胞介素23(IL-23)抑制剂。为我国克罗恩病患者,特别是中重度患者提供了一种全新的治疗手段。
5、司库奇尤单抗(诺华):
目前国内首个且唯一被批准用于治疗强直性脊柱炎的白介素类抑制剂。研究发现,白介素-17A(IL-17A)是促进炎症级联反应、新骨生成、最终导致骨融合和完全强直的重要介质。作为目前全球首个且唯一全人源IL-17A抑制剂,司库奇尤单抗可特异性阻断任何来源的IL-17A,有效控制炎症并抑制新骨形成,多层调控病理进展。
6、利拉鲁肽注射液(诺和诺德):
作为最主要的GLP-1受体激动剂之一,利拉鲁肽注射液是目前唯一证明可以降低心血管死亡风险的人GLP-1类似物(截至2020年5月14日)。该药的心血管获益来自于其对心脏和血管的直接保护作用,可持续改善动脉粥样硬化。一项多国家、多中心的长期心血管结局试验LEADER研究(Marso SP, et al.N Engl J Med. 2016 Jul 28;375(4):311-22.)证实了该药卓越的心血管获益能够显著降低主要心血管不良事件(MACE)发生风险,包括:心血管死亡、非致死性心肌梗死或非致死性卒中。事后分析也提示利拉鲁肽注射液具有独立于他汀治疗之外的心血管获益机制。
7、塞瑞替尼胶囊(诺华):
首个进入中国的二代ALK抑制剂,满足此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK )阳性的局部晚期或者转移性非小细胞肺癌(NSCLC)患者的迫切需求。
8、乙磺酸尼达尼布软胶囊(勃林格殷格翰):
全球首个也是目前唯一用于系统性硬化病相关间质性肺疾病(SSc-ILD)的药物,其标志着系统性硬化病相关间质性肺疾病(SSc-ILD)患者走出了无药可医的困境。
9、重组人生长激素注射液(诺和诺德):
一项Noonan综合征患者使用重组人生长激素注射液进行治疗的临床试验显示,长期重组人生长激素治疗可改善患者终身高,患者平均身高增加约10.4厘米;重组人生长激素治疗的患者可达到接近父母中位身高;且患者长期重组人生长激素治疗耐受性良好(Osio D et al. Acta Paediatr 2005;94:1232–7)。
10、帕博利珠单抗注射液(默沙东):
帕博利珠单抗此次获批突破了过往食管癌治疗手段有限的情况,提升我国食管癌治疗的整体有效率,显著延长食管癌患者的生存,给中国的食管鳞癌患者的二线治疗带来了免疫治疗新选择。
自从2015年药监审评审批制度改革以来,我国创新药的引进大大提速,其中2017到2019年RDPAC会员企业累计向中国市场引进了超过100种创新药物,占同期中国市场所有上市创新药物的80%,让更多的中国患者享受到世界级创新的成果。RDPAC将继续致力于加快创新药引入,助力中国政府强化对创新的激励与保护,提升我国患者的创新药可及性和可负担性,让患者用得上、用得起全球创新的临床急需用药。作为政府实现健康中国2030目标以及不断提高居民和患者生活质量的重要合作伙伴,RDPAC及会员企业愿意与社会各界通力合作,通过“共建共享”的路径铸造健康中国,以达到全民健康、长寿无忧的目的,实现健康中国2030目标。







